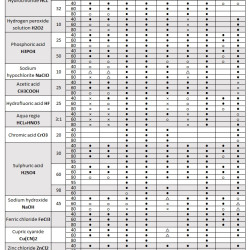
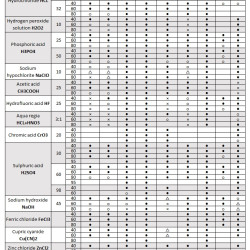
Lub wypełnij formularz na stronie
Pomoc w doborze
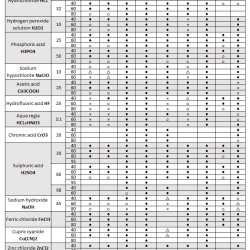
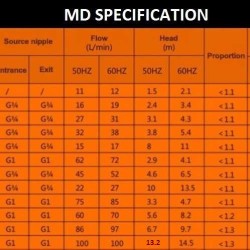
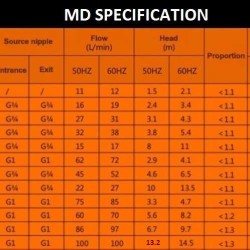
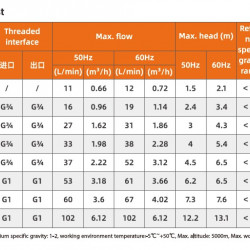
Pompy do galwanizacji
Galwanizacja to osadzanie metalu lub tlenku na powierzchni produktu w celu nadania mu nowych właściwości użytkowych lub poprawienia jego wyglądu. Galwanizacja odbywa się pod działaniem prądu elektrycznego, stąd pojęcie „elektrolizy”.
Z praktycznego punktu widzenia elektroliza to zespół reakcji redoks zachodzących pod wpływem prądu elektrycznego w elektrolicie.
Elektrolit to medium (dla klasycznej galwanizacji - roztwór wodny), które ma jonową przewodność elektryczną. Mówiąc najprościej, jest to ciecz, która może sama przez siebie przewodzić prąd. Prąd elektryczny przewodzą głównie jony solwatowane w rozpuszczalniku. Solwatacja to rodzaj „wyciągania” jonów ze stałej sieci krystalicznej ciała stałego przez dipole wody. W rezultacie każdy jon zostaje otoczony pewną liczbą cząsteczek wody i w tej formie przemieszcza się albo na elektrodę dodatnią, albo ujemną.
Kiedy przez elektrolit przepływa prąd elektryczny, początkowo w przewodnikach metalowych występuje ukierunkowany ruch elektronów. Z anody elektrony przechodzą do katody, w wyniku czego na anodzie powstaje nadmiar ładunku dodatniego. Gdy obwód elektryczny z zewnętrznym źródłem prądu jest włączony, elektrony zostaną odebrane atomom metalu podstawowego anody na anodzie rozpuszczalnej, a elektrony zostaną odjęte od tych anionów, które znajdują się w obszarze anody na anodzie. nierozpuszczalna anoda. Na katodzie pojawia się nadmiar ładunku ujemnego z powodu zgromadzonych na niej elektronów. Przeciwnie naładowane aniony zaczynają przemieszczać się w kierunku dodatniej anody, a kationy w kierunku katody. Jednocześnie po dotarciu do elektrod mogą ulegać pewnym przemianom chemicznym.
Prąd przepływający przez elektrolit jest zwykle stały, chociaż czasami może być zmienny lub zmieniać się w zależności od określonej funkcji. W każdym razie zawsze możemy wyróżnić procesy katodowe (redukcja) i anodowe (utlenianie).
Elektroliza nie musi zachodzić tylko w roztworach wodnych. Istnieją również niewodne układy elektrochemiczne oparte na rozpuszczalnikach organicznych (głównie aprotonowych), stopionych solankach, a nawet elektrolitach stałych, jednak ich przemysłowe zastosowanie do otrzymywania powłok metalicznych jest ograniczone, a w przypadku elektrolitów stałych zupełnie niemożliwe.
W galwanotechnice, w oparciu o powyższy schemat, mogą istnieć trzy opcje organizacji procesu:
- Elektroliza z anodami rozpuszczalnymi. Metal anody rozpuszcza się i jego jony przechodzą do roztworu, a te same jony są redukowane na katodzie i osadza się metaliczna powłoka. Przykładami takiego procesu są cynkowanie, miedziowanie, niklowanie itp.
- Elektroliza z nierozpuszczalnymi anodami. Anoda nie rozpuszcza się, zachodzi na niej reakcja uboczna, na przykład uwalnianie tlenu. Na katodzie metal jest redukowany, a jony są wyciągane z elektrolitu. Następuje ciągły spadek stężenia jonów metali w roztworze.
- Anodowanie - uzyskanie powłoki tlenkowej na części zawieszonej w wannie z anodą powoduje wydzielanie się wodoru na katodzie. Urządzenie do przeprowadzania elektrolizy nazywa się elektrolizerem. Mały elektrolizer laboratoryjny jest powszechnie określany jako ogniwo, natomiast zakład przemysłowy będzie określany jako kąpiel galwaniczna.
Schemat najprostszego elektrolizera (rysunek 1 i 2) zawsze obejmuje:
- elektrolit, przez który przepływa prąd elektryczny;
- katoda(y) - części powlekane (ujemny biegun elektryczny, na którym zachodzi proces przyjmowania elektronów - odzyskiwanie).
- Katodę, na którą nakłada się powłokę, można również nazwać podłożem lub podstawą, a powłokę na katodzie - osadem;
- anody - przeciwelektrody (dodatni biegun elektryczny, na którym zachodzi proces odrzutu elektronu - utleniania);
- źródło prądu elektrycznego.
W przypadku nanoszenia anodowej powłoki tlenkowej, na przykład na aluminium (proces anodowania), powlekane przedmioty znajdują się na anodzie, a katody działają jako przeciwelektrody.
Elektrolizer można wyposażyć w dodatkowe wyposażenie:
- grzejniki;
- systemy mieszania;
- systemy filtracyjne;
- ssania boczne;
- pokrowce;
- czujniki parametrów technologicznych (temperatura, pH, poziom, potencjał, stężenie składników itp.), dozowniki i inne urządzenia automatyki.